7.2.1 Zustandsänderungen des idealen Gases
Die Zustandsgleichung des idealen Gases (+)
Video 1: Die Zustandsgleichung des idealen Gases (C)
.
Als ideales Gas bezeichnet man ein Gas, in dem man die Gasmoleküle näherungsweise als Massenpunkte ansehen kann, die nur durch elastische Stöße miteinander und mit anderen Objekten (z.B. Wänden) wechselwirken. Anziehungskräfte zwischen den Gasmolekülen werden also ebenso vernachlässigt wie die innere Struktur der Moleküle und deren Eigenvolumen. Edelgase wie Helium erfüllen diese Voraussetzungen sehr gut. Aber auch andere Gase kann man als ideale Gase behandeln, wenn man sie genügend weit verdünnt. Für ein solches Gas gilt die Zustandsgleichung des idealen Gases:
Beispiel
7.2.1
Ein Mol eines idealen Gases nimmt bei Normwerten (, Atmosphärendruck) ein Volumen von ein:
Ein Mol eines idealen Gases nimmt bei Normwerten (, Atmosphärendruck) ein Volumen von ein:
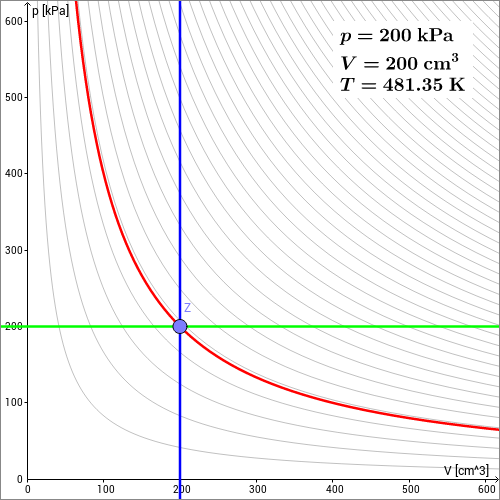
Der Zustand eines idealen Gases kann in einem sogenannten --Diagramm dargestellt werden. Hier ist der Gasdruck in Abhängigkeit vom Volumen , welches das Gas einnimmt, aufgetragen. Betrachtet man Zustände mit konstanter Temperatur, gilt . Daraus folgt:
Zustände konstanter Temperatur liegen also auf Hyperbeln.
Dieser Sachverhalt ist in der nächsten animierten Skizze dargestellt. In dem --Diagramm sind als dünne graue Linien die Hyperbeln eingezeichnet, die jeweils Zuständen mit konstanter Temperatur entsprechen. Ein verschiebbarer Punkt stellt den Zustand eines idealen Gases dar, das eine Stoffmenge von enthält. Über die Gasgleichung ist dann bei vorgegebenem Druck und Volumen die Temperatur eindeutig bestimmt. Sehen Sie sich dies an, indem Sie den Zustand durch Bewegen des Punktes in der --Ebene variieren.
Zustandsänderungen eines Gases (+)
Der Zustand eines idealen Gases ist gekennzeichnet durch die drei variablen Größen , und . (Die Stoffmenge des Gases wird für die folgenden Betrachtungen als konstant angenommen.) Eine Zustandsänderung beschreibt den Übergang von einem Zustand 1 (gekennzeichnet durch , und ) in einen Zustand 2 (gekennzeichnet durch , und ). Dabei lassen sich prinzipiell drei Zustandsänderungen unterscheiden:
- isotherme Zustandsänderung: Die Temperatur wird durch Anbindung an ein äußeres Wärmebad konstant gehalten (). Diese Zustandsänderung wird durch die Hyperbeln in der oben gezeigten Skizze beschrieben.
- isochore Zustandsänderung: Das Volumen wird konstant gehalten (). Es ändern sich Temperatur und Druck des Gases.
- isobare Zustandsänderung: Der Druck wird konstant gehalten (). Es ändern sich Temperatur und Volumen.
Volumenarbeit eines Gases (+)
Video 2: Zustandsänderungen und Volumenarbeit (C)
.
Wird das Volumen eines Gases geändert, so muss am Gas Arbeit verrichtet werden (bei Verringerung des Volumens) oder das Gas leistet Arbeit am äußeren System (bei Vergrößerung des Volumens). Diese mechanische Arbeit kann man sich mit Hilfe der folgenden Skizze herleiten:
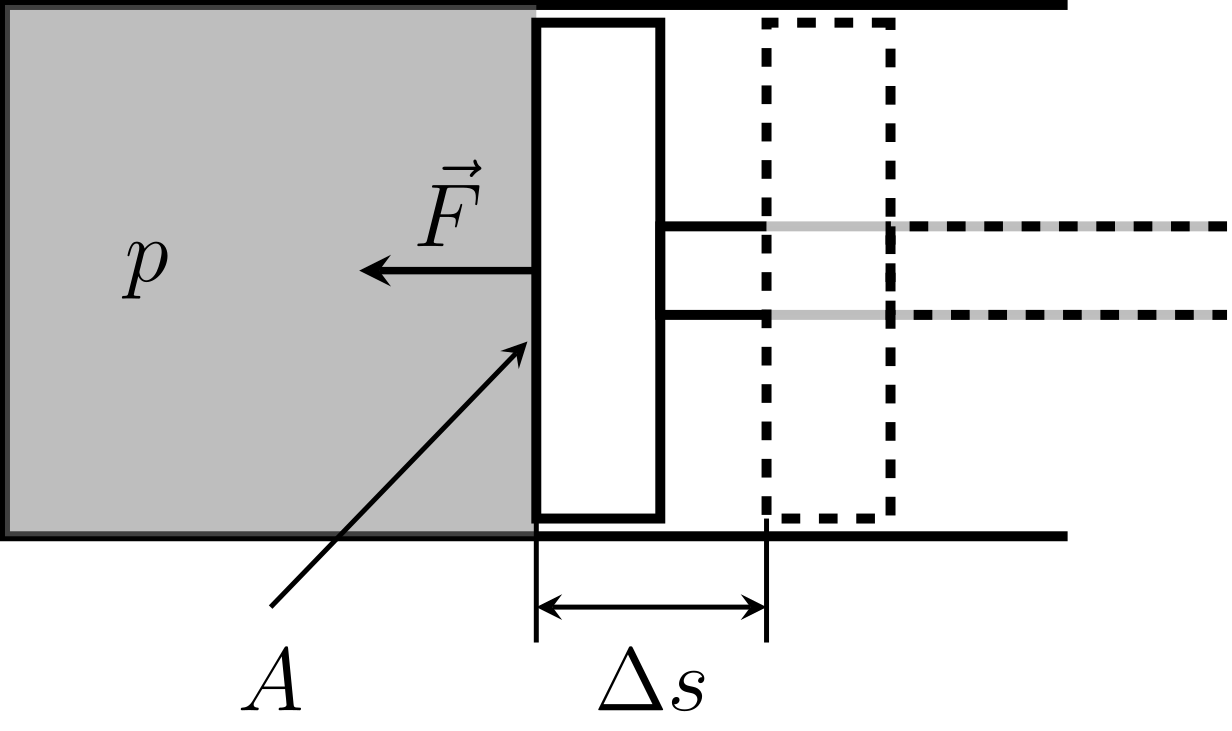
Abbildung 7.2.2: Komprimierung eines Gases mittels Kolben (C)
Man betrachtet die Bewegung eines Kolbens der Fläche um die Strecke . sei sehr klein, sodass während dieses Prozesses der Druck des Gases als konstant angenommen werden kann. Aus der Mechanik ist bekannt, dass die durch eine Kraft entlang eines Wegs verrichtete Arbeit gegeben ist durch
wenn und parallel sind und in die gleiche Richtung zeigen. Nach Definition ist Druck eine Kraft auf eine Fläche:
Das ist die Kraft, die aufgewendet werden muss, um den Kolben zu bewegen. Dabei wird die Arbeit am Gas geleistet. Die dabei erfolgte Volumenänderung ist . Das Minuszeichen kommt daher, dass sich das Volumen beim Hineindrücken des Kolbens verkleinert.
Man erhält also insgesamt für die am Gas geleistete Arbeit:
Die obige Beziehung wurde für konstanten Druck hergeleitet. Ändert sich der Druck während der Volumenänderung, so muss man die Beziehung durch eine Integration ersetzen:
Innere Energie und Erster Hauptsatz der Wärmelehre (+)
Video 3: Innere Energie und Erster Hauptsatz der Wärmelehre (C)
.
Der Erste Hauptsatz der Wärmelehre ist die Anwendung des Energieerhaltungssatzes auf die Wärmelehre. Wie oben diskutiert, können einem idealen Gas zwei Formen von Energie zugeführt bzw. entzogen werden:
- Die Wärmemenge bezeichnet die Energie, die nur durch statistische elastische Stöße auf das System übertragen wurde, also nur durch Änderung der Temperatur, ohne dass das Volumen sich ändert.
- Die Volumenarbeit bezeichnet die Energie, die dem System durch Kompression/Expansion zugeführt bzw. entzogen wurde. Hierbei kann sich die Temperatur des Systems geändert haben, muss es aber nicht. Die Volumenarbeit berücksichtigt nur die Änderung des Volumens.
Beim idealen Gas trägt bei konstantem Volumen zugeführte Wärme vollständig zur Erhöhung der inneren Energie bei. Damit gilt für ein ideales Gas
mit der Molzahl und der molaren Wärmekapazität des Gases für die Temperaturänderung bei konstant gehaltenem Volumen. Bei einem einatomigen idealen Gas findet man experimentell . Lässt man auch Volumenänderungen zu, so ergibt sich folgende Energieerhaltungsgleichung:
Die Zugeführte Wärme teilt sich auf in Erhöhung der inneren Energie und Arbeit. In der Form
ist das die mathematische Formulierung des Ersten Hauptsatzes für ein ideales Gas
Die innere Energie charakterisiert ein thermodynamisches System vollständig, solange kein Teilchenaustausch stattfindet. Diese Definition gilt nicht nur für ideale Gase. Sie kann auf jedes thermodynamische System angewendet werden. Dann ist nicht mehr nur die Volumenarbeit, sondern jede Form von Arbeit, die an dem System verrichtet werden kann (z.B. magnetische oder elektrische Arbeit).
Der Erste Hauptsatz der Wärmelehre lautet: Die Änderung der inneren Energie eines Systems ist gleich der Summe aus der zugeführten Wärmemenge und der am System geleisteten Arbeit ,

