7.2.2 Thermodynamische Prozesse und Maschinen
Video 15: Innere Energie bei thermodynamischen Prozessen (C)
.
In diesem Teil betrachten wir thermodynamische Maschinen, die durch Zustandsänderungen eines idealen Gases angetrieben werden. Dafür ist es zunächst notwendig, die Änderung der inneren Energie für die verschiedenen möglichen Zustandsänderungen zu berechnen.
Isothermer Prozess (*)
Beim isothermen Prozess ändert sich die Temperatur des Gases nicht. Da die Temperatur ein Maß für die thermische Energie der Gasteilchen ist, ist sie direkt proportional zur inneren Energie . Bei einem isothermen Prozess ändert sich die innere Energie des Gases daher nicht:
Mit Hilfe des Ersten Hauptsatzes erhält man dann für die Wärme :
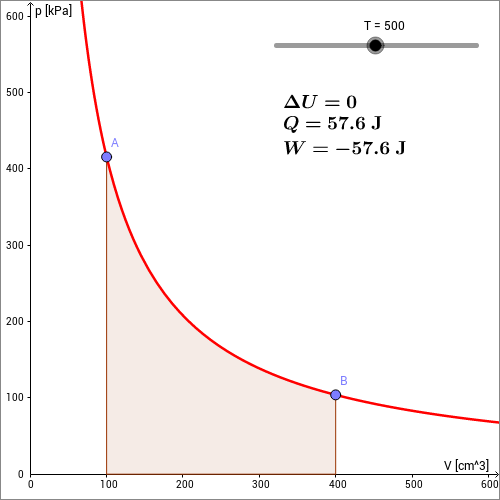
Bei der isothermen Expansion (Vergrößerung von aufgrund der Erwärmung) leistet das Gas Arbeit. Da die innere Energie unverändert bleibt, muss eine der geleisteten Arbeit entsprechende Menge an Wärmeenergie dem Gas zugeführt werden. Die dem Gas zugeführte Wärmeenergie wird also in mechanische Arbeit umgewandelt.
Während jeder kleinen Volumenänderung wird vom Gas die Arbeit geleistet. Die Gesamtarbeit erhält man durch Integration von nach . Da das Gas Arbeit leistet, hat das Integral ein negatives Vorzeichen:
Mit der Beziehung für aus der idealen Gasgleichung
ergibt sich für die Volumenarbeit:
In der folgenden animierten Skizze ist die isotherme Expansion eines Gases vom Punkt zum Punkt dargestellt. Durch Änderung der Temperatur kann die zugeführte Wärmemenge und damit die geleistete Arbeit verändert werden.
 Diese Interaktion wurde mit GeoGebra erstellt (www.geogebra.org)
Diese Interaktion wurde mit GeoGebra erstellt (www.geogebra.org)
Isochorer Prozess (*)
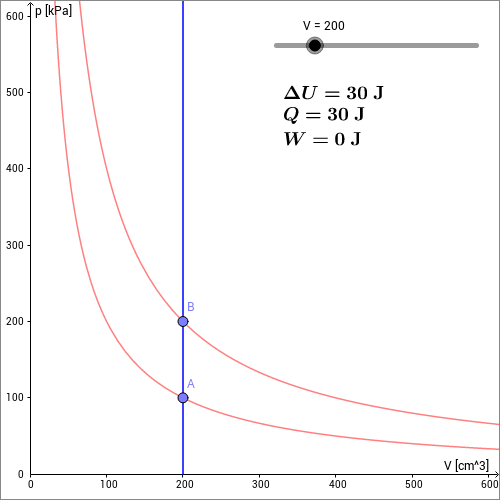
Beim isochoren Prozess bleibt das Volumen des Gases konstant. Das Gas leistet daher keine Arbeit, und es wird keine Arbeit am Gas verrichtet. Es gilt also:
Aus dem Ersten Hauptsatz der Wärmelehre folgt dann für :
Die dem Gas zugeführte Wärmeenergie führt daher nur zur Erhöhung von Temperatur und Druck.
In der folgenden animierten Skizze ist eine isochore Erwärmung des Gases zwischen den Zuständen und gezeigt. Durch die Temperaturerhöhung erhöht sich die innere Energie des Gases gemäß der kinetischen Gastheorie um:
Diese Beziehung gilt allerdings nur für einatomige ideale Gase.
 Diese Interaktion wurde mit GeoGebra erstellt (www.geogebra.org)
Diese Interaktion wurde mit GeoGebra erstellt (www.geogebra.org)
Weitere thermodynamische Prozesse (*)
Außer dem isothermen und dem isochoren Prozess kennt man noch isobare Prozesse, bei denen der Druck konstant bleibt (). Hier wird sowohl Arbeit geleistet als auch Wärmeenergie transportiert sowie die Temperatur und damit die innere Energie geändert.
Schließlich gibt es adiabatische Prozesse, die dadurch definiert sind, dass keine Wärmeenergie vom Gas aufgenommen oder abgegeben wird ().
Der Kreisprozess nach Stirling (*)
Isothermer Prozess (*)
Beim isothermen Prozess ändert sich die Temperatur des Gases nicht. Da die Temperatur ein Maß für die thermische Energie der Gasteilchen ist, ist sie direkt proportional zur inneren Energie . Bei einem isothermen Prozess ändert sich die innere Energie des Gases daher nicht:
Mit Hilfe des Ersten Hauptsatzes erhält man dann für die Wärme :
Bei der isothermen Expansion (Vergrößerung von aufgrund der Erwärmung) leistet das Gas Arbeit. Da die innere Energie unverändert bleibt, muss eine der geleisteten Arbeit entsprechende Menge an Wärmeenergie dem Gas zugeführt werden. Die dem Gas zugeführte Wärmeenergie wird also in mechanische Arbeit umgewandelt.
Während jeder kleinen Volumenänderung wird vom Gas die Arbeit geleistet. Die Gesamtarbeit erhält man durch Integration von nach . Da das Gas Arbeit leistet, hat das Integral ein negatives Vorzeichen:
Mit der Beziehung für aus der idealen Gasgleichung
ergibt sich für die Volumenarbeit:
In der folgenden animierten Skizze ist die isotherme Expansion eines Gases vom Punkt zum Punkt dargestellt. Durch Änderung der Temperatur kann die zugeführte Wärmemenge und damit die geleistete Arbeit verändert werden.

Isochorer Prozess (*)
Beim isochoren Prozess bleibt das Volumen des Gases konstant. Das Gas leistet daher keine Arbeit, und es wird keine Arbeit am Gas verrichtet. Es gilt also:
Aus dem Ersten Hauptsatz der Wärmelehre folgt dann für :
Die dem Gas zugeführte Wärmeenergie führt daher nur zur Erhöhung von Temperatur und Druck.
In der folgenden animierten Skizze ist eine isochore Erwärmung des Gases zwischen den Zuständen und gezeigt. Durch die Temperaturerhöhung erhöht sich die innere Energie des Gases gemäß der kinetischen Gastheorie um:
Diese Beziehung gilt allerdings nur für einatomige ideale Gase.

Weitere thermodynamische Prozesse (*)
Außer dem isothermen und dem isochoren Prozess kennt man noch isobare Prozesse, bei denen der Druck konstant bleibt (). Hier wird sowohl Arbeit geleistet als auch Wärmeenergie transportiert sowie die Temperatur und damit die innere Energie geändert.
Schließlich gibt es adiabatische Prozesse, die dadurch definiert sind, dass keine Wärmeenergie vom Gas aufgenommen oder abgegeben wird ().
Der Kreisprozess nach Stirling (*)
Video 16: Der Kreisprozess nach Stirling (C)
.
Ein Kreisprozess ist dadurch definiert, dass das Gas nach Durchlauf des gesamten Prozesses wieder in den ursprünglichen Zustand zurückgekehrt ist. Bei einem Kreisprozess im Uhrzeigersinn wird vom Gas mehr Arbeit geleistet als am Gas Arbeit verrichtet wird. Man spricht in einem solchen Fall von einer Wärmekraftmaschine. Die insgesamt durch das System geleistete Arbeit entspricht der vom Kreisprozess umschlossenen Fläche im --Diagramm.
In der folgenden animierten Skizze ist dies für einen speziellen Kreisprozess dargestellt, dem sogenannten Stirling-Prozess. Dieser besteht aus einer isothermen Expansion (), einer isochoren Abkühlung (), einer isothermen Kompression () und einer isochoren Erwärmung (). Da das Gas nach Durchlaufen des Kreisprozesses wieder den alten Zustand eingenommen hat, ist die innere Energie unverändert. Die insgesamt vom System geleistete Arbeit muss dann gleich der Differenz zwischen der vom System aufgenommenen und und der vom System abgegebenen Wärmemenge sein. Der Kreisprozess wandelt also Wärmeenergie in mechanische Arbeit um.
Man beachte folgende Vorzeichenkonvention:
: Das Gas leistet Arbeit.
: Arbeit wird am Gas geleistet.
: Das Gas leistet Arbeit.
: Arbeit wird am Gas geleistet.
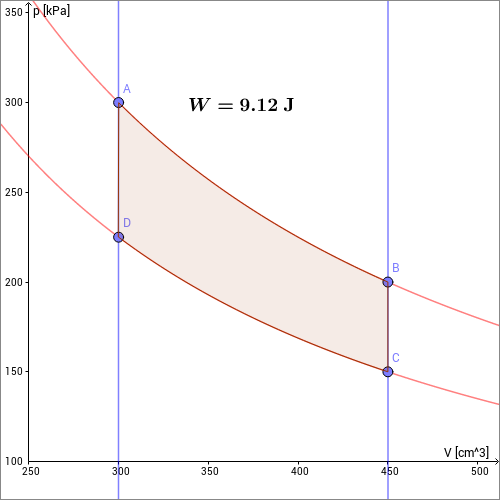
Der Prozess beginnt am Punkt : Das Gas ist komprimiert () und aufgeheizt ().
- : isotherme Expansion: Das Gas wird bei der hohen Temperatur der geheizten Zone () auf ein Volumen expandiert.
Für die am Gas geleistete Volumenarbeit ergibt sich
d.h. das Gas leistet die Volumenarbeit . Da die Temperatur durch eine externe Heizung konstant gehalten wird, wird dem Gas außerdem die Wärmemenge zugeführt.
- : isochore Abkühlung: Das Gas wird ohne Volumenänderung () in die gekühlte Zone befördert und dort auf die Temperatur abgekühlt.
Das Gas leistet keine Arbeit (), aber es wird auf die Temperatur abgekühlt. Dabei wird ihm Wärme entzogen: . Dabei ist die Wärmekapazität des Gases bei konstantem Volumen.
- : isotherme Kompression: Das abgekühlte Gas wird bei der niedrigen Temperatur der gekühlten Zone () auf ein Volumen komprimiert.
Am Gas wird die Volumenarbeit
geleistet. Da die Temperatur durch eine externe Kühlung konstant gehalten wird, wird dem Gas außerdem die Wärmemenge entzogen.
- : isochore Aufheizung: Das komprimierte Gas wird ohne Volumenänderung () in die geheizte Zone befördert und dort wieder auf aufgeheizt.
Das Gas wird auf die Temperatur erwärmt. Dabei wird ihm die Wärmemenge zugeführt. Da das Volumen sich nicht ändert, wird am Gas keine Arbeit geleistet ().
Die technische Realisierung des Stirling-Prozesses ist der Stirling-Motor. Schematisch ist seine Funktionsweise in der folgenden Skizze gezeigt.
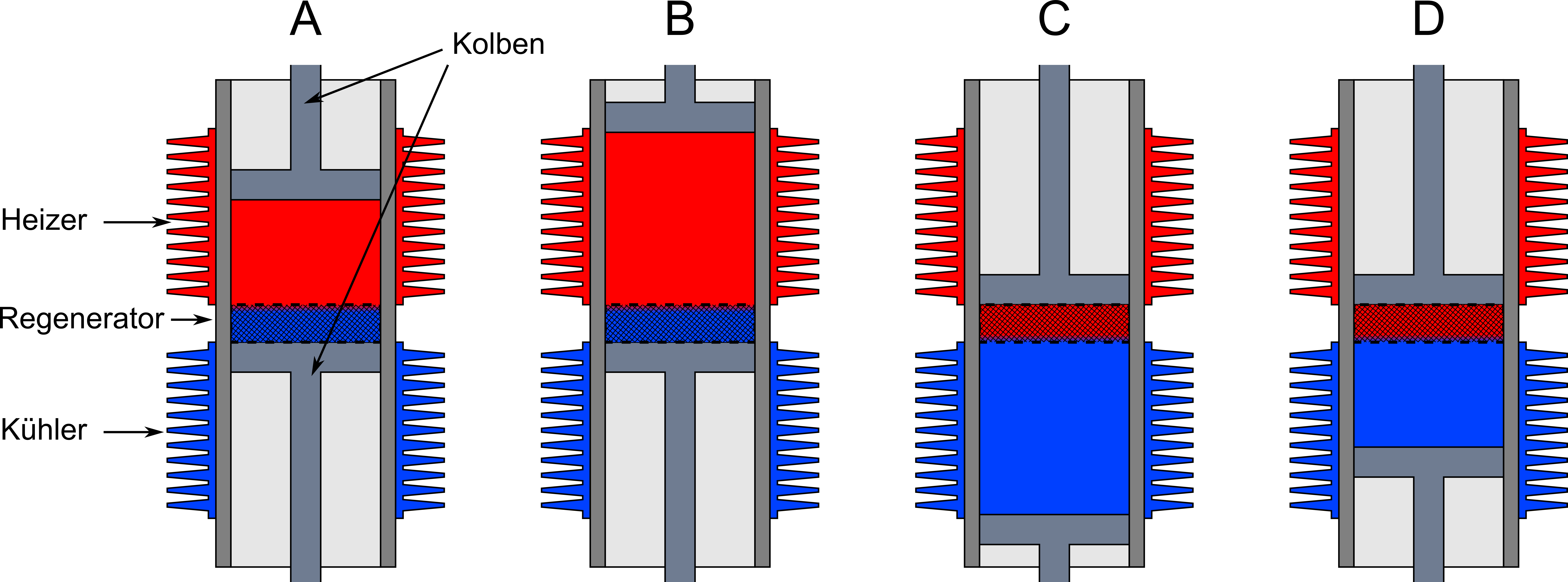
Abbildung 7.2.22: Illustration der Funktionsweise eines Striling-Motors (C)
Wirkungsgrad (*)
Video 17: Der Wirkungsgrad Teil 1 (C)
.
Video 18: Der Wirkungsgrad Teil 2 (C)
.
Der Wirkungsgrad einer Wärmekraftmaschine ist definiert als das Verhältnis aus der Arbeit , die die Maschine leistet, und der Energie , die man der Maschine in Form von Wärme zuführen muss. Für den Stirling-Prozess ergibt sich:
Dabei wurde und eingesetzt. Da und ist, ist . Netto hat das Gas also Arbeit verrichtet.
Beim idealen Stirling-Prozess nimmt man an, dass die beim Abkühlen im Schritt dem Gas entzogene Wärmemenge in einem sogenannten Regenerator zwischengespeichert und in Schritt dem Gas wieder vollständig zugeführt werden kann. Wegen bzw. tragen diese beiden isochoren Prozesse daher weder zur von außen zugeführten Wärmemenge noch zur vom Gas ans kalte Temperaturniveau abgegebenen Verlustwärme bei.
Die zugeführte Wärme ist also
und die Verlustwärme
Wie zu erwarten, entspricht die insgesamt umgesetzte Wärme der geleisteten Arbeit:
Für den Wirkungsgrad ergibt sich:
Man sieht, dass der Wirkungsgrad umso größer ist, je größer der Temperaturunterschied zwischen Heizer und Kühler ist. Für sehr große Temperaturdifferenzen können Wirkungsgrade sehr nahe an realisiert werden. Ein Wirkungsgrad gleich oder gar größer als ist aber nicht möglich.
Das besagt auch der Zweite Hauptsatz der Thermodynamik:
Es gibt keine periodisch arbeitende Maschine, die Wärme in mechanische Arbeit umwandelt, ohne dass dabei ein Teil der zugeführten Wärme wieder abgegeben wird.
Es gibt keine periodisch arbeitende Maschine, die Wärme in mechanische Arbeit umwandelt, ohne dass dabei ein Teil der zugeführten Wärme wieder abgegeben wird.
Schematisch kann man das wie folgt skizzieren:
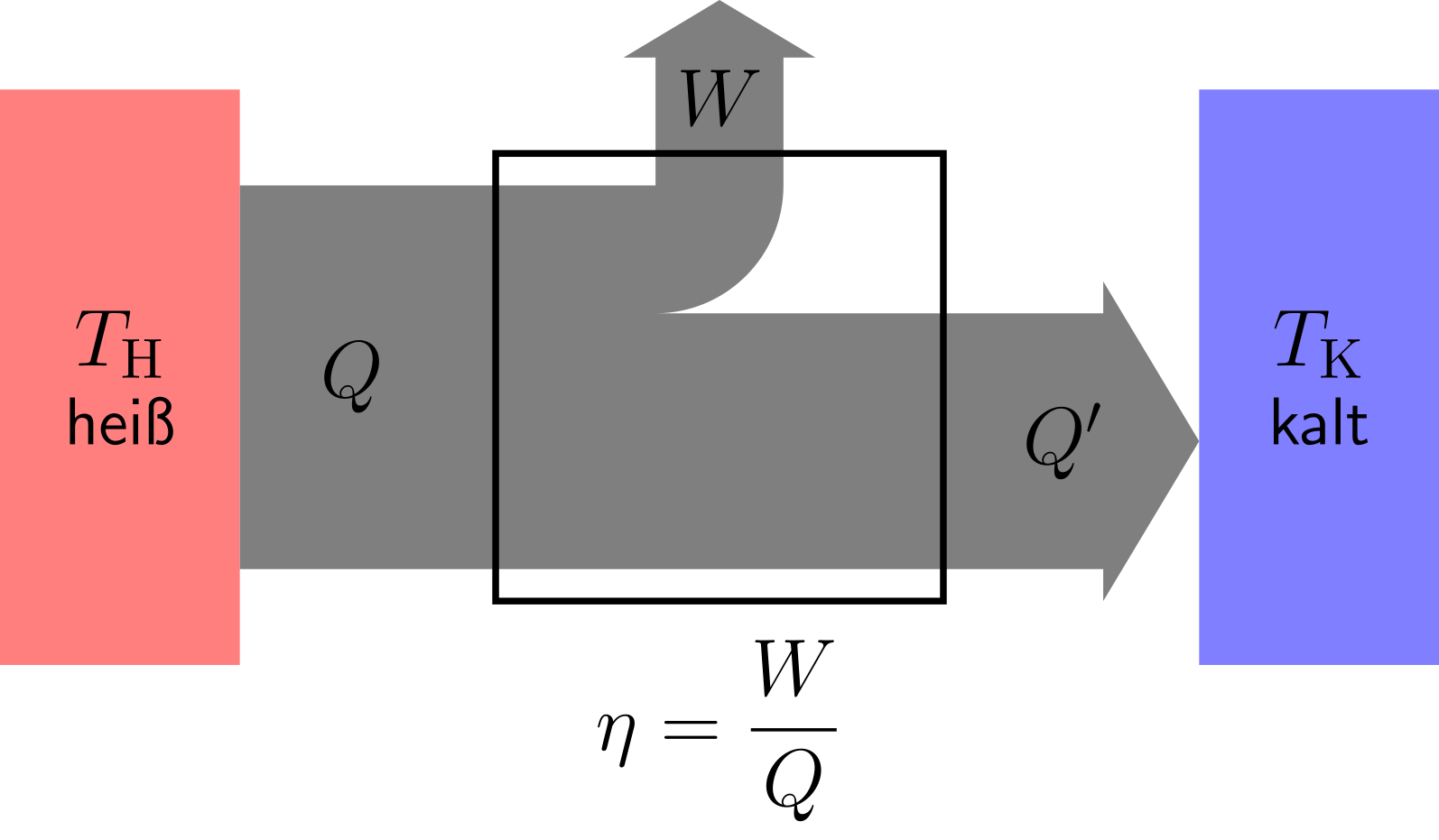
Abbildung 7.2.23: Energiefluss einer Wärmekraftmaschine (C)
Die Wärmeenergie wird in das System eingebracht. Im oben dargestellten Stirling-Prozess wird ein Teil der Wärmeenergie in die mechanische Arbeit umgewandelt. Er wird also als Wärmekraftmaschine betrieben.
Der Wirkungsgrad ergibt sich als Quotient aus der gewonnenen Arbeit und der eingesetzten Wärmeenergie . Die ans kalte Temperaturniveau abgegebene Wärmeenergie ist der Verlust.
Beispiel
7.2.6
Für einen Stirling-Motor, der zwischen einer Temperatur und einer Temperatur betrieben wird, ist der Wirkungsgrad
Für einen Stirling-Motor, der zwischen einer Temperatur und einer Temperatur betrieben wird, ist der Wirkungsgrad
Umkehrung des Kreisprozesses (*)
Kehrt man den Kreisprozess um, wird am System Arbeit verrichtet. Im Gegenzug wird Wärmeenergie vom kalten Temperaturniveau zum heißen Temperaturniveau transportiert. Man spricht dann von einer Wärmepumpe.
Eine bekannte Anwendung des Prinzips der Wärmepumpe ist der Kühlschrank, bei dem unter Aufwendung von mechanischer Arbeit (Kompressormotor des Kühlschranks) dem Inneren des Kühlschranks Wärmeenergie entzogen und an die Umgebung abgegeben wird. Der Wirkungsgrad einer solchen Wärmepumpe ist das Verhältnis aus der abgeführten Wärmemenge und der eingesetzten mechanischen Arbeit:
Im Gegensatz zu Wärmekraftmaschinen können Wärmepumpen daher Wirkungsgrade erreichen, die deutlich größer als 1 sind!
Beispiel
7.2.7
Ein handelsüblicher Kühlschrank kühlt von Raumtemperatur () auf (ca. ) ab. Sein theoretischer Wirkungsgrad als ideale Stirling-Wärmepumpe ist demnach
Ein handelsüblicher Kühlschrank kühlt von Raumtemperatur () auf (ca. ) ab. Sein theoretischer Wirkungsgrad als ideale Stirling-Wärmepumpe ist demnach
Typische Wirkungsgrade:
| Wirkungsgrad | |
| Dampfmaschine | |
| Stirling-Motor | |
| Ottomotor | |
| Dieselmotor | |
| Klimaanlage |

